COLEGIO DE BACHILLERATO
"CIUDAD DE CUENCA"
ESTUDIANTE
DORIS GOMEZ
MATERIA
QUIMICA
TEMA
COMPUESTOS QUIMICOS
CURSO
PRIMERO "F"
AÑO - LECTIVO
2016 - 2017
COMPUESTOS QUIMICOS
COMPUESTOS QUIMICOS
― Simbolos de los Elementos Quimicos
Los símbolos químicos
son los distintos signos abreviados que se utilizan para identificar
los elementos y compuestos químicos en lugar de sus nombres completos..
La mayoría de los símbolos químicos se derivan de las letras del nombre del elemento, principalmente en latín, pero a veces en inglés, alemán, francés o ruso. La primera letra del símbolo se escribe con mayúscula, y la segunda (si la hay) con minúscula.
Este conjunto de símbolos que denomina a los elementos químicos es universal. Los símbolos de los elementos pueden ser utilizados como abreviaciones para nombrar al elemento, pero tanbien se utilizan en formulas y ecuaciones para indicar una cantidad relativa fija.
La mayoría de los símbolos químicos se derivan de las letras del nombre del elemento, principalmente en latín, pero a veces en inglés, alemán, francés o ruso. La primera letra del símbolo se escribe con mayúscula, y la segunda (si la hay) con minúscula.
Este conjunto de símbolos que denomina a los elementos químicos es universal. Los símbolos de los elementos pueden ser utilizados como abreviaciones para nombrar al elemento, pero tanbien se utilizan en formulas y ecuaciones para indicar una cantidad relativa fija.
Símbolo
químico
químico
| Nombre español |
Nombre inglés |
Número atómico |
Origen del símbolo | |
| Ac | Actinio | Actinium | 89 | from Greek aktinos |
| Ag | Plata | Silver | 47 | Latin argentum |
| Al | Aluminio | Aluminium (Aluminum) | 13 | Latin alumen |
| Am | Americio | Americium | 95 | the Americas |
| Ar | Argón | Argon | 18 | Greek argon |
| As | Arsénico | Arsenic | 33 | Greek arsenikos |
| At | Astato | Astatine | 85 | Greek astatos |
| Au | Oro | Gold | 79 | Latin aurum |
| B | Boro | Boron | 5 | borax |
| Ba | Bario | Barium | 56 | Greek barys |
| Be | Berilio | Beryllium | 4 | beryl |
| Bh | Bohrio | Bohrium | 107 | Niels Bohr |
| Bi | Bismuto | Bismuth | 83 | from German wissmuth |
| Bk | Berkelio | Berkelium | 97 | Berkeley, California |
| Br | Bromo | Bromine | 35 | Greek bromos |
| C | Carbono | Carbon | 6 | Latin carbo |
| Ca | Calcio | Calcium | 20 | Latin calx |
| Cd | Cadmio | Cadmium | 48 | from Greek kadmia |
| Ce | Cerio | Cerium | 58 | Ceres |
| Cf | Californio | Californium | 98 | State and University of California |
| Cl | Cloro | Chlorine | 17 | Greek chloros |
| Cm | Curio | Curium | 96 | Pierre and Marie Curie and the traditional -um ending |
| Co | Cobalto | Cobalt | 27 | from German kobold |
| Cr | Cromo | Chromium | 24 | Greek chroma |
| Cs | Cesio | Caesium (Cesium) | 55 | Latin caesius |
| Cu | Cobre | Copper | 29 | Latin Cuprum |
| Db | Dubnio | Dubnium | 105 | Dubna, Russia |
| Ds | Darmstadtio | Darmstadtium | 110 | Darmstadt, Germany |
| Dy | Disprosio | Dysprosium | 66 | Greek dysprositos |
| Er | Erbio | Erbium | 68 | Ytterby, Sweden |
| Es | Einsteinio | Einsteinium | 99 | Albert Einstein |
| Eu | Europio | Europium | 63 | Europe |
| F | Flúor | Fluorine | 9 | Latin fluo |
| Fe | Hierro | Iron | 26 | Latin ferrum |
| Fm | Fermio | Fermium | 100 | Enrico Fermi |
| Fr | Francio | Francium | 87 | France |
| Ga | Galio | Gallium | 31 | Latin Gallia |
| Gd | Gadolinio | Gadolinium | 64 | gadolinite |
| Ge | Germanio | Germanium | 32 | Germany |
| H | Hidrógeno | Hydrogen | 1 | Greek hydror |
| He | Helio | Helium | 2 | Greek helios |
| Hf | Hafnio | Hafnium | 72 | Latin Hafnia |
| Hg | Mercurio | Mercury | 80 | Latin hydrargyrum |
| Ho | Holmio | Holmium | 67 | Latin Holmia |
| Hs | Hassio | Hassium | 108 | Hesse, Germany |
| I | Yodo | Iodine | 53 | Greek ioeides |
| In | Indio | Indium | 49 | indigo blue |
| Ir | Iridio | Iridium | 77 | Greek iris |
| K | Potasio | Potassium (Kalium) | 19 | Latin kalium |
| Kr | Kriptón | Krypton | 36 | Greek kryptos |
| La | Lantano | Lanthanum | 57 | Greek lanthanien |
| Li | Litio | Lithium | 3 | Greek lithos |
| Lr | Lawrencio | Lawrencium | 103 | Ernest O. Lawrence |
| Lu | Lutecio | Lutetium | 71 | Latin Lutetia |
| Md | Mendelevio | Mendelevium | 101 | Dmitri Mendeleyev |
| Mg | Magnesio | Magnesium | 12 | Magnesia, Greece |
| Mn | Manganeso | Manganese | 25 | Latin magnes |
| Mo | Molibdeno | Molybdenum | 42 | Greek molybdos |
| Mt | Meitnerio | Meitnerium | 109 | Lise Meitner |
| N | Nitrógeno | Nitrogen | 7 | Greek nitron |
| Na | Sodio | Sodium | 11 | Latin natrium |
| Nb | Niobio | Niobium | 41 | Niobe |
| Nd | Neodimio | Neodymium | 60 | Greek neos didymos |
| Ne | Neón | Neon | 10 | Greek neos |
| Ni | Níquel | Nickel | 28 | German kupfernickel |
| No | Nobelio | Nobelium | 102 | Alfred Nobel |
| Np | Neptunio | Neptunium | 93 | Neptune |
| O | Oxígeno | Oxygen | 8 | Greek oxys |
| Os | Osmio | Osmium | 76 | Greek osme |
| P | Fósforo | Phosphorus | 15 | Greek phosphoros |
| Pa | Protactinio | Protactinium | 91 | Greek protos and actinium |
| Pb | Plomo | Lead | 82 | Latin plumbum |
| Pd | Paladio | Palladium | 46 | Pallas and the traditional -dium ending |
| Pm | Prometio | Promethium | 61 | Prometheus |
| Po | Polonio | Polonium | 84 | Poland |
| Pr | Praseodimio | Praseodymium | 59 | Greek prasios |
| Pt | Platino | Platinum | 78 | Greek platina |
| Pu | Plutonio | Plutonium | 94 | Pluto |
| Ra | Radio | Radium | 88 | Latin radius |
| Rb | Rubidio | Rubidium | 37 | Latin rubidus |
| Re | Renio | Rhenium | 75 | German Rheinprovinz |
| Rf | Rutherfordio | Rutherfordium | 104 | Ernest Rutherford |
| Rg | Roentgenio | Roentgenium | 111 | Wilhelm Conrad Röntgen |
| Rh | Rodio | Rhodium | 45 | Greek rhodon |
| Rn | Radón | Radon | 86 | radium and emanation |
| Ru | Rutenio | Ruthenium | 44 | Latin Ruthenia |
| S | Azufre | Sulfur (Sulphur) | 16 | Latin sulfur |
| Sb | Antimonio | Antimony | 51 | Latin stibium |
| Sc | Escandio | Scandium | 21 | Scandinavia |
| Se | Selenio | Selenium | 34 | Greek selene |
| Sg | Seaborgio | Seaborgium | 106 | Glenn T. Seaborg |
| Si | Silicio | Silicon | 14 | Latin silex |
| Sm | Samario | Samarium | 62 | samarskite |
| Sn | Estaño | Tin | 50 | Latin stannum |
| Sr | Estroncio | Strontium | 38 | Latin Strontian |
| Ta | Tantalio | Tantalum | 73 | King Tantalus |
| Tb | Terbio | Terbium | 65 | Ytterby, Sweden |
| Tc | Tecnecio | Technetium | 43 | Greek technetos |
| Te | Telurio | Tellurium | 52 | Greek tellus |
| Th | Torio | Thorium | 90 | Thor |
| Ti | Titanio | Titanium | 22 | the Titans |
| Tl | Talio | Thallium | 81 | Greek thallos |
| Tm | Tulio | Thulium | 69 | Thule and the traditional -ium ending |
| U | Uranio | Uranium | 92 | Uranus |
| Uub | Ununbio | Ununbium | 112 | Latin uni, uni, and bi |
| Uuh | Ununhexio | Ununhexium | 116 | Latin uni, uni, and Greek hex |
| Uuo | Ununoctio | Ununoctium | 118 | Latin uni, uni, and oct |
| Uup | Ununpentio | Ununpentium | 115 | Latin uni, uni, and Greek pent |
| Uug | Ununquadio | Ununquadium | 114 | Latin uni, uni, and quadr |
| Uus | Ununseptio | |||
| Uut | Ununtrio | Ununtrium | 113 | Latin uni, uni, and Greek tri |
| V | Vanadio | Vanadium | 23 | Vanadis |
| W | Wolframio | Tungsten | 74 | German wolfram |
| Xe | Xenón | Xenon | 54 | Greek xenos |
| Y | Itrio | Yttrium | 39 | Ytterby, Sweden |
| Yb | Iterbio | Ytterbium | 70 | Ytterby, Sweden |
| Zn | Zinc | Zinc | 30 | German zin |
| Zr | Circonio | Zirconium | 40 | zircon |
| Desde la antiguedad los adquimistas empleaban simbolos para representar de los elementos y compuestos que hasta entonses conocian. | |||
| Dalton fue el primero en utilizar un sistema de signos para los diferentes elementos y para algunos Compuestos. Los simbolos modernos se deben a Berzelius quien propuso utilizar en vez de signos arbitrarios, la primera letra del nombre latino del elemento: Oxigeno (O) Nitrogeno (N) Hidrogeno (H). | |||
 |
|||
| FORMULAS QUIMICAS | |||
| Una formula es una expresion Simbolica de la composicion y estructura de una sustancia quimica. | |||
| Cada compuesto quimico se designa mediante una formula especifica que contiene simbolos de los elementos que la componen y unos subindices que expresan la relacion numerica entre los elementos. | |||
 VALENCIA Y NUMERO DE OXIDACION
La valencia, también conocida como número
de valencia, es una medida de
la cantidad de enlaces químicosformados
por los átomos de un elemento químico. A
través del siglo XX, el concepto de valencia ha evolucionado en un amplio rango
de aproximaciones para describir el enlace químico, incluyendo la estructura de Lewis (1916),
la teoría
del enlace de valencia (1927), la teoría
de los orbitales moleculares (1928), la teoría de repulsión de pares electrónicos de la capa de
valencia (1958)
y todos los métodos avanzados de química cuántica.
Valencia positiva máxima:
Es el número positivo que refleja la máxima
capacidad de combinación de un átomo. Este número coincide con el Grupo de la
Tabla Periódica al cual pertenece. Por ejemplo: el Cloro (Cl) es del Grupo VII
A en la tabla, por lo que su valencia positiva máxima es 7.
Valencia negativa:
Es el
número negativo que refleja la capacidad que tiene un átomo de combinarse con
otro pero que obviamente esté actuando con valencia positiva. Este número
negativo se puede determinar contando lo que le falta a la valencia positiva
máxima para llegar a 8, pero con signo -.
Por
ejemplo: a la valencia máxima positiva del átomo de cloro es 7, por lo que le
falta un electrón para cumplir el octeto, entonces su valencia negativa será -1
Trabajo, con los avances en la teoría del
enlace químico, pero aún es usado ampliamente en estudios elementales donde
provee una introducción heurística a la materia.NÚMERO DE OXIDACIÓNSe denomina número de oxidación a la carga que se le asigna a un átomo cuando los electrones de enlace se distribuyen según ciertas reglas un tanto arbitrarias. Las reglas son: Los electrones compartidos por átomos de idéntica electronegatividad se distribuyen en forma equitativa entre ellos. Los electrones compartidos por átomos de diferente electronegatividad se le asignan al más electronegativo. Luego de esta distribución se compara el número de electrones con que ha quedado cada átomo con el número que posee el átomo neutro, y ése es el número de oxidación. Éste se escribe, en general, en la parte superior del símbolo atómico y lleva el signo escrito. Por ejemplo: Vamos a determinar el número de oxidación del Cl en Cl2 y en HCl. Los dos electrones de enlace se reparten uno para cada átomo, ya que por tratarse de átomos del mismo elemento, obviamente tendrán igual valor de electronegatividad. Cada átomo de Cl queda ahora con 7 electrones de valencia, que son los mismo que tiene el átomo neutro, lo que determina que su número de oxidación sea 0. Los dos electrones de enlace se le asignan al Cl por ser el átomo de mayor electronegatividad, quedando así, con 8 electrones de valencia, uno más que los del átomo neutro, por lo que su número de oxidación es –1. El H ha quedado sin su único electrón, y su número de oxidación es +1. De las dos reglas anteriores surge una serie de reglas prácticas que permiten asignar números de oxidación sin necesidad de representar las estructuras de Lewis, las cuales a veces pueden ser complejas o desconocidas. 
CALCULO DEL NUMERO DE OXIDACION
Para determinar el numero de oxidacion de un elemento en una especie quimica cualquiera debemos tener en cuenta las siguientes reglas: Los atomos de los elementos que no forman parte de un compuesto quimico tienen nucleo de oxdacion cero(O) incluso cuando forman moleculas o estructuras poliatomicas como N2 herrro... El numero de oxidacion de un ion moonoatomico es su propia carga asi Na+ tiene un numero de oxidacion de +1 y Cl -1. El oxigeno emplea comunmente el numero de oxidacion -2 El hidrogeno utiliza habitualmente el numero de oxidacion +1 solo en los hidruros utiliza el numero de oxidacion -1 La suma algebraica de todos los numeros de oxidacionde los atomos que intervienen en la formula de una sustancia neutra debe ser cero.
GASES MONOATOMICOS
Son los gases nobles cuyas formulas son:
He(Helio)
Ne(Neon)
Ar(Argon)
Kr(Cripton)
Xe(Xenon)
COMPUESTOS BINARIOS

FORMULACION DE LOS COMPUESTOS BINARIOS
Si el compuesto esta formado por un elemento metalico y otro no metalico el metal metalico se coloca siempre a la hizquierda del elemento que aparece antes en la siguiente lista:
B, Si, C, Sb, As, P, N, H, Te

FUNSION OXIDO BASICO U OXIDOS METALICOS
Los oxidos metalicos estan compuestos por un elemento metal mas oxigeno.
Este grupo de compuestos son conocidos tambien como oxidos basicos
Metal + Oxigeno → Oxido Basico

OXOACIDOS
Formulación de los oxoácidosLa fórmula general de los oxoácidos es HaXbOc donde el hidrógeno actúa con número de oxidación +1, el oxígeno actúa con número de oxidación -2 y el número de oxidación del elemento no metálico se calcula según la siguiente fórmula:X = (2c - a) / b Nomenclatura de los oxoácidosPara la nomenclatura de los oxoácidos puede utilizarse la nomenclatura tradicional, nomenclatura de stock así como la nomenclatura sistemática.
Ejemplos:
HBrO: ácido hipobromoso HBrO2: ácido bromoso HBrO3: ácido brómico HBrO4: ácido perbrómico H2N2O2 » HNO: ácido hiponitroso HNO2: ácido nitroso HNO3: ácido nítrico
FUNSION SAL
Llamamos sales a los compuestos que son el resultado de la union de un cation cualquiera con un aunion distinto.
jLa mayoria de las Combinaciones binarias de un metal con un no metal son sales. Asi tenemos por ejemplo el claruro de Sodio y el sulfuro de potasio
NaCl→contiene el cation Na+ y el anion Cl-
K2S→contiene el cation K+ y el anion S2
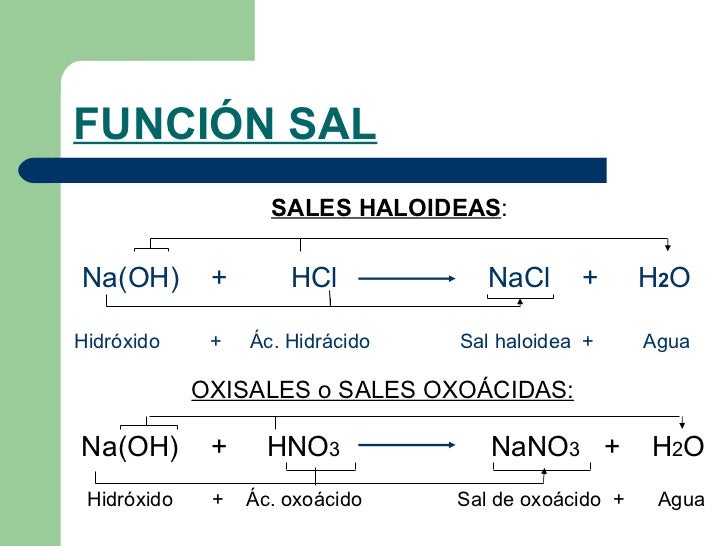
OXISALES NEUTRAS
Son compuestos ternarios constituidos por un no metal,
oxígeno y metal. Se obtienen por neutralización total de un hidróxido
sobre un ácido oxoácido. La reacción que tiene lugar es:
ÁCIDO OXOÁCIDO + HIDRÓXIDO --> SAL NEUTRA + AGUA La neutralización completa del ácido por la base lleva consigo la sustitución de todos los iones hidrógeno del ácido por el catión del hidróxido, formándose además agua en la reacción. Puede, pues, considerarse como compuestos binarios formados por un catión (proveniente de la base) y un anión (que proviene del ácido). En la fórmula se escribirá primero el catión y luego el anión. Al leer la fórmula el orden seguido es el inverso.Para nombrar las sales neutras, basta utilizar el nombre del anión correspondiente y añadirle el nombre del catión, según hemos indicado anteriormente. Si el anión tiene subíndice, se puede expresar con los prefijos multiplicativos bis, tris, tetrakis, pentakis, etc. No obstante, si se indica la valencia del metal no son precisos estos prefijos, pues queda suficientemente clara la nomenclatura del compuesto. SALES ACIDAS A estas sales las obtenemos por la neutralizacion parcial de los H+ del acido los OH de la base o hidroxido o por la sustitucion parcial de los hidrogenos de los acidos por cationes metalicos. Una de las sales acidas mas utilizadas es el cloruro de amonio. El cual se produce mediante la siguiente reaccion.
HCl + NH3→NH4Cl
LiOH + H2CO3 = Li(HCO3) + H2O
SALES DOBLES
Son compuestos que resultan de la sustitucion total de los hidrogenos del acido por dos metales diferentes tambien estas sales pueden ser halogenas y oxisales
BiIBrCl= bromuro-cloruro-yoduro de bismuto
LiMgP = Fosfuro doble de Litio y Magnesio.
LiRbSe = Selenuro doble de Litio y Rubidio. KNaS = Sulfuro doble de sodio y potasio. KMgCl3 =cloruro (doble) de magnesio-potasio KNaCO3 =carbonato (doble) de potasio-sodio, trioxocarbonato (doble) de potasio-sodio CsBa(NO3)3 nitrato (doble) de bario-cesio, trioxonitrato (V) de bario-cesio KNaFeS2 sulfuro (triple) de hierro (II)-potasio-sodio
SAL HALOGENA DOBLE
LiOH + NaOH + 2HCI⇾LiNaCI + 2H2O
Li---------OH----------H----------CI
⇾⇾⇾ LiNaCI2+2H2O
Na--------.OH----------H----------CI
FUNCION PEROXIDO
Se define como un superoxido ya que contiene mayor cantidadad de oxigeno que los oxidos basicos
Se forman por la reaccion de los oxidos de la primera y segunda familia de los metales con los oxigenos.
Para formar el peroxido de cadmio con el oxigeno y obtenemos el peroxido de cambio.
El nombre generico es la palabra peroxido y el especifico el nombre del metal del cual proviene.
 | |||
Comentarios
Publicar un comentario